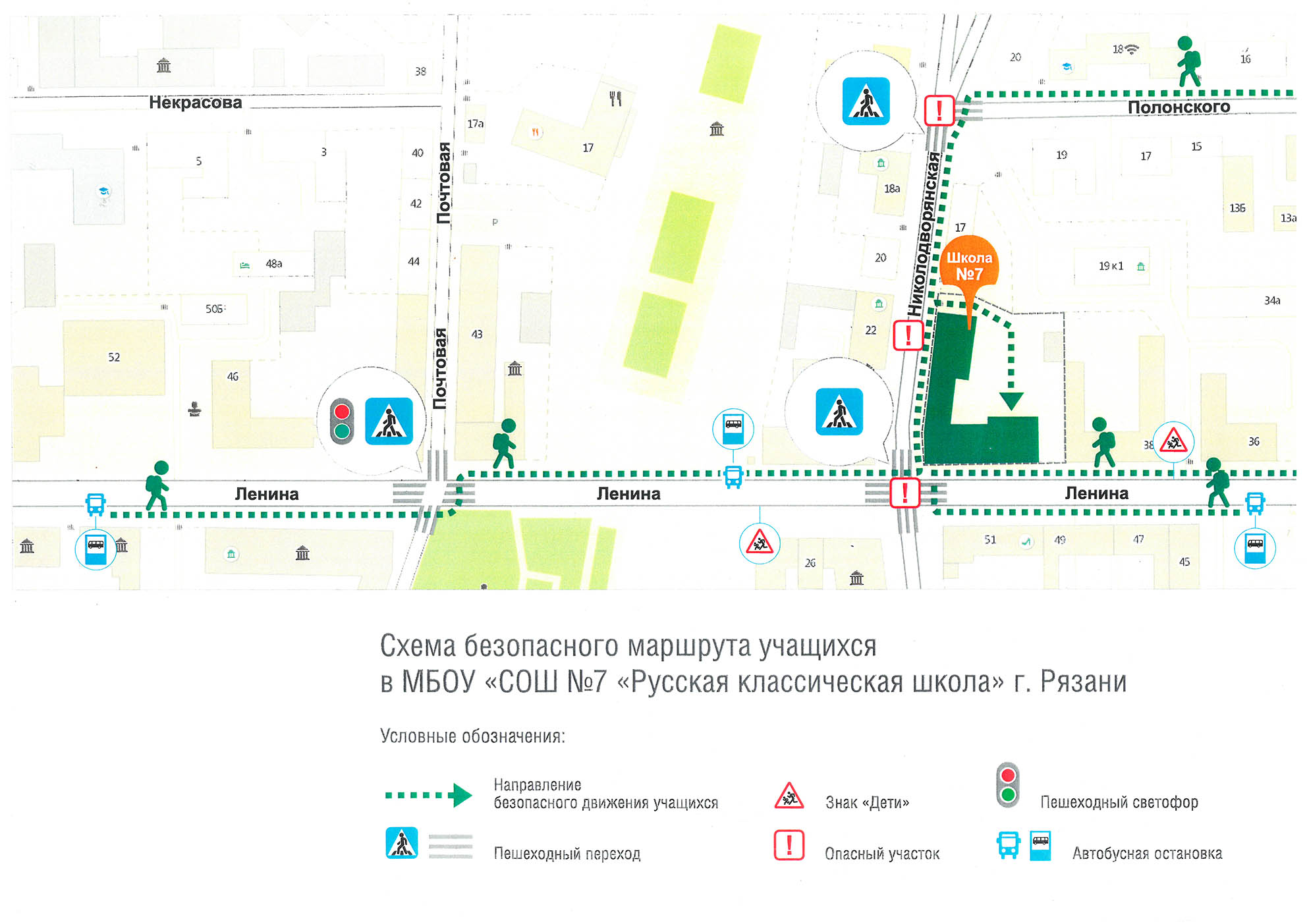
- Пояснительная записка Рабочая программа учебного курса по предмету Химия для 8-9 классов составлена в соответствии с:
- Федеральным законом Российской Федерации от 29 декабря 2012 г. N 273-ФЗ «Об образовании в Российской Федерации»;
- Федеральным государственным образовательным стандартом основного общего образования (Утвержден приказом Министерства образования и науки Российской Федерации от 17 декабря 2010 г. № 1897);
- Приказом Министерства образования и науки РФ от 31 декабря 2015 года №1577 «О внесении изменений в Федеральный государственный образовательный стандарт основного общего образования, утвержденный приказом Министерства образования и науки РФ от 17 декабря 2010 г. № 1577»;
- Образовательной программой основного общего образования МБОУ «Школа №7 «Русская классическая школа»; Учебным планом основного общего образования МБОУ «Школа №7 «Русская классическая школа» на 2021-2022 учебный год;
Рабочая программа предусматривает реализацию учебников, рекомендованных к использованию в образовательном процессе в ОУ, реализующих образовательные программы общего образования и имеющих государственную аккредитацию (приказ Минобрнауки России от 13.12.07 № 349):
Н.Е.Кузнецова, И.М.Титова, Н.Н.Гара, А.Ю.Жегин. Химия. 8 класс. - М.: Вентана-Граф. Н.Е.Кузнецова, И.М.Титова, Н.Н.Гара. Химия. 9 класс. - М.: Вентана-Граф.
Задачники:
Н.Е.Кузнецова, А.Н.Лёвкин. Задачник по химии. 8 класс. - М.: Вентана-Граф. Н.Е.Кузнецова, А.Н.Лёвкин. Задачник по химии. 9 класс. - М.: Вентана-Граф.
Цель курса - вооружение учащихся основами химических знаний, необходимых для повседневной жизни, производственной деятельности, продолжения образования, правильной ориентации и поведении в окружающей среде, внесение существенного вклада в развитие научного миропонимания учащихся.
|
В данной программе выражена гуманистическая и химико - экологическая направленность и ориентация на развивающее обучение. В отражена система важнейших химических знаний, раскрыта роль химии в познании окружающего мира, в повышении уровня материал жизни общества, в развитии его культуры, в решении важнейших проблем современности. Задачи курса: §вооружить учащихся знаниями основ науки и химической технологии, способами их добывания, переработки и применения; §раскрыть роль химии в познании природы и обеспечении жизни общества, показать значение общего химического образования для правил ориентации в жизни в условиях ухудшении экологической обстановки; §внести вклад в развитие научного миропонимания ученика; §развить внутреннюю мотивацию учения, повысить интерес к познанию химии; §развить экологическую культуру учащихся. Данная программа ориентирована на общеобразовательные классы. Помимо основ науки, в содержание предмета химия включен ряд сведений занимательного, исторического, прикладного харак содействующих мотивации учения, развитию познавательных интересов и решению других задач воспитания личности. |
ней ьной
ьной |
|
тера, |
В программе реализованы следующие направления: гуманизации содержания и процесса его усвоения; экологизации курса химии; интеграции знаний и умений; последовательного развития и усложнения учебного материала и способов его изучения.
Актуальность: в системе естественно-научного образования химия как учебный предмет занимает важное место в познании законов природы, в материальной жизни общества, в решении глобальных проблем человечества, в формировании научной картины мира, а также в воспитании экологической культуры людей.
Химия как учебный предмет вносит существенный вклад в научное миропонимание, в воспитание и развитие учащихся; призвана вооружить учащихся основами химических знаний, необходимых для повседневной жизни, заложить фундамент для дальнейшего совершенствования химических знаний как в старших классах, так и в других учебных заведениях, а также правильно сориентировать поведение учащихся в окружающей среде.
В содержании данного курса представлены основополагающие химические теоретические знания, включающие изучение состава и строения веществ, зависимости их свойств от строения, конструирование веществ с заданными свойствами, исследование закономерностей химических превращений и путей управления ими в целях получения веществ, материалов, энергии.
Принципы обучения химии, подходы к определению содержания курсов химии, последовательность изложения материала, методы и средства обучения, организация уроков химии, контроль усвоения знаний рассматривается в методике обучения химии.
В программе и учебнике реализованы следующие приоритетные идеи:
Гуманизация – с её позиций обучающийся – это высшая ценность, школа – среда, обеспечивающая условия для полноценного развития обучения, развития личности и индивидуальности обучающегося. Важнейшей задачей гуманизации учения является сознательный выбор своей индивидуальной образовательной траектории.
Интеграция – направлена на уплотнение и минимизацию содержания, укрепление дидактических единиц и расширение поля творческой деятельности.
Обобщение и систематизация – направлена на уплотнение тем курса и умения применять интегрированные знания на практике. Фундаментализация и методологизация – учитывается теоретико-экспериментальный характер науки и раскрываются методы исследования веществ, способы действий к их применению. Задания методологического характера включены в тексты учебников и в систему самостоятельной работы обучающихся.
Экологизация – экологическая направленность предметной области «Химия» раскрывает основные проблемы экологии, связанные с химией, пути их решения, роли химической науки и производства.
Практическая направленность – выделены прикладные системы знаний, специальные главы для более полного раскрытия и обобщения практического материала, показаны значение, технологии получения и применение веществ в жизни человека.
Система контроля и оценки учебных достижений учащихся по химии: в своей работе использую общепринятые виды контроля – текущий, тематический и тестовый, а также разноуровневую диагностику, что позволяет не только определить, какой результат достигнут при изучении материала, но и более полно и своевременно выявить основные пробелы в знаниях и умениях учеников, а также спланировать работу по их коррекции.
- Общая характеристика учебного предмета «Химия»
Естественнонаучное образование - один из компонентов подготовки подрастающего поколения к самостоятельной жизни. Оно обеспечивает всестороннее развитие личности ребёнка за время его обучения и воспитания в школе.
Химия - неотъемлемая часть культуры. Поэтому необходима специальная психологическая подготовка, приводящая учащихся к осознанию важности изучения основного курса химии.
Предмет химии специфичен. Успешность его изучения связана с овладением химическим языком, соблюдением техники безопасности при выполнении химического эксперимента, осознанием многочисленных связей химии с другими предметами.
От подготовленности, целевых установок миллионов российских школьников зависит то, насколько мы сможем выбрать и обеспечить инновационный путь развития страны.
Содержание данной программы имеет гуманистическую и химико – экологическую направленность и ориентацию на развивающие обучение. В нем отражена система важнейших химических знаний, раскрыта роль химии в познавании окружающего мира, в повышении уровня материальной жизни общества, в развитии его культуры, в решении важнейших проблем современности. Оно представлено тремя блоками знаний: о веществе, химической реакции и о прикладной химии (химической технологии и применении веществ), развиваемыми по спирали, отражающей повышение теоретического уровня изучения и обобщения знаний.
Курс химии 8 класса предполагает изучение двух разделов. Первый посвящен теоретическим объяснениям химических явлений на основе атомно – молекулярного учения и создает прочную базу для дальнейшего изучения курса химии. Особое внимание уделено формированию системы основных химических понятий и языку науки; жизненно веществам и явлениям, химическим реакциям, которые рассматриваются на атомно – молекулярном уровне. Второй раздел посвящен изучению электронной теории и рассмотрению на ее основе периодического закона и системы химических элементов, строения и свойств веществ, а также сущности химических реакций.
Значительное место в содержании курса отводится химическому эксперименту. Он открывает возможность формировать у учащихся специальные предметные умения:
- · работать с веществами;
- · выполнять простые химические опыты;
- · учит школьников безопасному и экологически грамотному обращению с веществами в быту и на производстве
- Описание места учебного предмета «Химия» в учебном плане
Согласно действующему Базисному учебному плану рабочая программа для 8 класса предусматривает обучение химии в объеме 2 часов в неделю (базовый уровень).
Программа построена с учетом реализации межпредметных связей с курсом физики 7 класса, где изучаются основные сведения о строении молекул и атомов, и биологии 6—9 классов, где дается знакомство с химической организацией клетки и процессами обмена веществ.
Принципы отбора основного и дополнительного материала связаны с преемственностью целей образования на разных этапах обучения, логикой внутрипредметных связей, а также с возрастными особенностями развития обучающихся.
Информация о количестве учебных часов: 2 часа в неделю, всего 68 часов, контрольных работ 4, практических работ 4. 4. Личностные, метапредметные и предметные результаты освоения
учебного предмета «Химия»
Методической основой изучения курса « Химия» в основной школе является системно - деятельностный подход обеспечивающий достижение личностных, метапредметных и предметных результатов посредством организации активной познавательной деятельности школьников.
Личностные результаты
- · осознавать единство и целостность окружающего мира, возможности его познаваемости и объяснимости на основе достижений науки;
- · постепенно выстраивать собственное целостное мировоззрение: осознавать потребность и готовность к самообразованию, в том числе и в рамках самостоятельной деятельности вне школы;
- · оценивать жизненные ситуации с точки зрения безопасного образа жизни и сохранения здоровья; · оценивать экологический риск взаимоотношений человека и природы.
- · формировать экологическое мышление: умение оценивать свою деятельность и поступки других людей с точки зрения сохранения окружающей среды - гаранта жизни и благополучия людей на Земле.
Метапредметные результаты –освоение курса « Химия» на уровне основного общего образования включает в соответствии ФГОС ООО 3 группы универсальных учебных действий: регулятивные,познавательные и коммуникативные.
Регулятивные УУД:
- · самостоятельно обнаруживать и формулировать учебную проблему, определять цель учебной деятельности;
- · выдвигать версии решения проблемы, осознавать конечный результат, выбирать из предложенных и искать самостоятельно средства достижения цели;
- · составлять (индивидуально или в группе) план решения проблемы;
- · работая по плану, сверять свои действия с целью и, при необходимости, исправлять ошибки самостоятельно; · в диалоге с учителем совершенствовать самостоятельно выработанные критерии оценки.
Познавательные УУД:
- · анализировать, сравнивать, классифицировать и обобщать факты и явления. Выявлять причины и следствия простых явлений. · осуществлять сравнение, классификацию, самостоятельно выбирая основания и критерии для указанных логических операций; · строить логическое рассуждение, включающее установление причинно-следственных связей.
- · создавать схематические модели с выделением существенных характеристик объекта. · составлять тезисы, различные виды планов (простых, сложных и т.п.).
- · преобразовывать информацию из одного вида в другой (таблицу в текст и пр.).
- · уметь определять возможные источники необходимых сведений, производить поиск информации, анализировать и оценивать её достоверность.
Коммуникативные УУД:
- · Спорит и отстаивает свою позицию не враждебным для оппонентов образом.
- · Осуществляет взаимный контроль и оказывает в сотрудничестве необходимую взаимопомощь.
- · Организовывает и планирует учебное сотрудничество с учителем и сверстниками; определяет цели и функции участников, способы взаимодействия; планирует общие способы работы.
- · Умеет работать в группе – устраивает рабочие отношения, эффективно сотрудничает и способствует продуктивной кооперации; интегрируется в группу сверстников и строит продуктивное взаимодействие со сверстниками и взрослыми.
- · Учитывает разные мнения и интересы, обосновывает собственную позицию. Предметные результаты
- · осознание роли веществ:
- определять роль различных веществ в природе и технике; - объяснять роль веществ в их круговороте.
- · рассмотрение химических процессов:
- приводить примеры химических процессов в природе;
- находить черты, свидетельствующие об общих признаках химических процессов и их различиях. · использование химических знаний в быту:
– объяснять значение веществ в жизни и хозяйстве человека. · объяснять мир с точки зрения химии:
– перечислять отличительные свойства химических веществ; – различать основные химические процессы;
- определять основные классы неорганических веществ; - понимать смысл химических терминов.
- · овладение основами методов познания, характерных для естественных наук:
- характеризовать методы химической науки (наблюдение, сравнение, эксперимент, измерение) и их роль в познании природы; - проводить химические опыты и эксперименты и объяснять их результаты.
- · умение оценивать поведение человека с точки зрения химической безопасности по отношению к человеку и природе: - использовать знания химии при соблюдении правил использования бытовых химических препаратов;
– различать опасные и безопасные вещества.
Выпускник в 8 классе научится:
- · характеризовать основные методы познания: наблюдение, измерение, эксперимент;
- · описывать свойства твердых, жидких, газообразных веществ, выделяя их существенные признаки;
- · раскрывать смысл основных химических понятий «атом», «молекула», «химический элемент», «простое вещество», «сложное вещество», «валентность», «химическая реакция», используя знаковую систему химии;
- · раскрывать смысл законов сохранения массы веществ, постоянства состава, атомно-молекулярной теории; · различать химические и физические явления;
- · называть химические элементы;
- · определять состав веществ по их формулам;
- · определять валентность атома элемента в соединениях; · определять тип химических реакций;
- · называть признаки и условия протекания химических реакций;
- · выявлять признаки, свидетельствующие о протекании химической реакции при выполнении химического опыта; · составлять формулы бинарных соединений;
- · составлять уравнения химических реакций;
- · соблюдать правила безопасной работы при проведении опытов; · пользоваться лабораторным оборудованием и посудой;
- · вычислять относительную молекулярную и молярную массы веществ;
- · вычислять массовую долю химического элемента по формуле соединения;
- · вычислять количество, объем или массу вещества по количеству, объему, массе реагентов или продуктов реакции; · характеризовать физические и химические свойства простых веществ: кислорода и водорода;
- · получать, собирать кислород и водород;
- · распознавать опытным путем газообразные вещества: кислород, водород; · раскрывать смысл закона Авогадро;
- · раскрывать смысл понятий «тепловой эффект реакции», «молярный объем»; · характеризовать физические и химические свойства воды;
- · раскрывать смысл понятия «раствор»;
- · вычислять массовую долю растворенного вещества в растворе;
- · приготовлять растворы с определенной массовой долей растворенного вещества; · называть соединения изученных классов неорганических веществ;
- · характеризовать физические и химические свойства основных классов неорганических веществ: оксидов, кислот, оснований, солей; · определять принадлежность веществ к определенному классу соединений;
- · составлять формулы неорганических соединений изученных классов;
- · проводить опыты, подтверждающие химические свойства изученных классов неорганических веществ; · распознавать опытным путем растворы кислот и щелочей по изменению окраски индикатора;
- · характеризовать взаимосвязь между классами неорганических соединений; · раскрывать смысл Периодического закона Д.И. Менделеева;
- · объяснять физический смысл атомного (порядкового) номера химического элемента, номеров группы и периода в периодической системе Д.И. Менделеева;
- · объяснять закономерности изменения строения атомов, свойств элементов в пределах малых периодов и главных подгрупп;
- · характеризовать химические элементы (от водорода до кальция) на основе их положения в периодической системе Д.И. Менделеева и особенностей строения их атомов;
- Содержание учебного предмета «Химия»
В системе естественнонаучного образования химия как учебный предмет занимает важное место в познании законов природы,
формировании научной картины мира, создании основы химических знаний, необходимых для повседневной жизни, навыков здорового и безопасного для человека и окружающей его среды образа жизни, а также в воспитании экологической культуры.
Успешность изучения химии связана с овладением химическим языком, соблюдением правил безопасной работы при выполнении
химического эксперимента, осознанием многочисленных связей химии с другими предметами школьного курса.
Программа включает в себя основы неорганической и органической химии. Главной идеей программы является создание базового комплекса опорных знаний по химии, выраженных в форме, соответствующей возрасту обучающихся.
В содержании данного курса представлены основополагающие химические теоретические знания, включающие изучение состава и строения веществ, зависимости их свойств от строения, прогнозирование свойств веществ, исследование закономерностей химических превращений и путей управления ими в целях получения веществ и материалов.
Теоретическую основу изучения неорганической химии составляет атомно-молекулярное учение, Периодический закон Д.И. Менделеева с краткими сведениями о строении атома, видах химической связи, закономерностях протекания химических реакций.
В изучении курса значительная роль отводится химическому эксперименту: проведению практических и лабораторных работ, описанию результатов ученического эксперимента, соблюдению норм и правил безопасной работы в химической лаборатории.
Реализация данной программы в процессе обучения позволит обучающимся усвоить ключевые химические компетенции и понять роль и значение химии среди других наук о природе.
Изучение предмета «Химия» в части формирования у обучающихся научного мировоззрения, освоения общенаучных методов (наблюдение, измерение, эксперимент, моделирование), освоения практического применения научных знаний основано на межпредметных связях с предметами: «Биология», «География», «История», «Литература», «Математика», «Основы безопасности жизнедеятельности», «Русский язык», «Физика», «Экология».
Первоначальные химические понятия
Предмет химии. Тела и вещества. Основные методы познания: наблюдение, измерение, эксперимент. Физические и химические явления. Чистые вещества и смеси. Способы разделения смесей. Атом. Молекула. Химический элемент. Знаки химических элементов. Простые и сложные вещества. Валентность. Закон постоянства состава вещества. Химические формулы. Индексы. Относительная атомная и молекулярная массы. Массовая доля химического элемента в соединении. Закон сохранения массы веществ. Химические уравнения. Коэффициенты. Условия и признаки протекания химических реакций. Моль – единица количества вещества. Молярная масса.
Кислород. Водород
Кислород – химический элемент и простое вещество. Озон. Состав воздуха. Физические и химические свойства кислорода. Получение и
применение кислорода. Тепловой эффект химических реакций. Понятие об экзо- и эндотермических реакциях. Водород – химический элемент и простое вещество. Физические и химические свойства водорода. Получение водорода в лаборатории. Получение водорода в промышленности. Применение водорода. Закон Авогадро. Молярный объем газов. Качественные реакции на газообразные вещества (кислород, водород). Объемные отношения газов при химических реакциях.
Вода. Растворы
Вода в природе. Круговорот воды в природе. Физические и химические свойства воды. Растворы. Растворимость веществ в воде. Концентрация растворов. Массовая доля растворенного вещества в растворе.
Основные классы неорганических соединений
Оксиды. Классификация. Номенклатура. Физические свойства оксидов. Химические свойства оксидов. Получение и применение оксидов. Основания. Классификация. Номенклатура. Физические свойства оснований. Получение оснований. Химические свойства оснований. Реакция нейтрализации. Кислоты. Классификация. Номенклатура. Физические свойства кислот. Получение и применение кислот. Химические свойства кислот. Индикаторы. Изменение окраски индикаторов в различных средах. Соли. Классификация. Номенклатура. Физические свойства солей. Получение и применение солей. Химические свойства солей. Генетическая связь между классами неорганических соединений. Проблема безопасного использования веществ и химических реакций в повседневной жизни. Токсичные, горючие и взрывоопасные вещества. Бытовая химическая грамотность.
Строение атома. Периодический закон и периодическая система химических элементов Д.И. Менделеева
Строение атома: ядро, энергетический уровень. Состав ядра атома: протоны, нейтроны. Изотопы. Периодический закон Д.И. Менделеева. Периодическая система химических элементов Д.И. Менделеева. Физический смысл атомного (порядкового) номера химического элемента, номера группы и периода периодической системы. Строение энергетических уровней атомов первых 20 химических элементов периодической системы Д.И. Менделеева. Закономерности изменения свойств атомов химических элементов и их соединений на основе положения в периодической системе Д.И. Менделеева и строения атома. Значение Периодического закона Д.И. Менделеева.
Строение веществ. Химическая связь
Электроотрицательность атомов химических элементов. Ковалентная химическая связь: неполярная и полярная. Понятие о водородной связи и ее влиянии на физические свойства веществ на примере воды. Ионная связь. Металлическая связь. Типы кристаллических решеток (атомная, молекулярная, ионная, металлическая). Зависимость физических свойств веществ от типа кристаллической решетки.
Химические реакции
Понятие о скорости химической реакции. Факторы, влияющие на скорость химической реакции. Понятие о катализаторе. Классификация химических реакций по различным признакам: числу и составу исходных и полученных веществ; изменению степеней окисления атомов химических элементов; поглощению или выделению энергии. Электролитическая диссоциация. Электролиты и неэлектролиты. Ионы. Катионы и анионы. Реакции ионного обмена. Условия протекания реакций ионного обмена. Электролитическая диссоциация кислот, щелочей и солей. Степень окисления. Определение степени окисления атомов химических элементов в соединениях. Окислитель. Восстановитель. Сущность окислительно-восстановительных реакций.
Неметаллы IV – VII групп и их соединения
Положение неметаллов в периодической системе химических элементов Д.И. Менделеева. Общие свойства неметаллов. Галогены: физические и химические свойства. Соединения галогенов: хлороводород, хлороводородная кислота и ее соли. Сера: физические и химические свойства. Соединения серы: сероводород, сульфиды, оксиды серы. Серная, сернистая и сероводородная кислоты и их соли. Азот: физические и химические свойства. Аммиак. Соли аммония. Оксиды азота. Азотная кислота и ее соли. Фосфор: физические и химические свойства. Соединения фосфора: оксид фосфора (V), ортофосфорная кислота и ее соли. Углерод: физические и химические свойства. Аллотропия углерода: алмаз, графит, карбин, фуллерены. Соединения углерода: оксиды углерода (II) и (IV), угольная кислота и ее соли. Кремний и его соединения.
Металлы и их соединения
Положение металлов в периодической системе химических элементов Д.И. Менделеева. Металлы в природе и общие способы их получения. Общие физические свойства металлов. Общие химические свойства металлов: реакции с неметаллами, кислотами, солями. Электрохимический ряд напряжений металлов. Щелочные металлы и их соединения. Щелочноземельные металлы и их соединения. Алюминий. Амфотерность оксида и гидроксида алюминия. Железо. Соединения железа и их свойства: оксиды, гидроксиды и соли железа (II и III).
Первоначальные сведения об органических веществах
Первоначальные сведения о строении органических веществ. Углеводороды: метан, этан, этилен. Источники углеводородов: природный газ, нефть, уголь. Кислородсодержащие соединения: спирты (метанол, этанол, глицерин), карбоновые кислоты (уксусная кислота, аминоуксусная кислота, стеариновая и олеиновая кислоты). Биологически важные вещества: жиры, глюкоза, белки. Химическое загрязнение окружающей среды и его последствия.
Типы расчетных задач:
- Вычисление массовой доли химического элемента по формуле соединения.
Установление простейшей формулы вещества по массовым долям химических элементов.
- реакции.
3.
Вычисления по химическим уравнениям количества, объема, массы вещества по количеству, объему, массе реагентов или продуктов
Расчет массовой доли растворенного вещества в растворе.
Примерные темы практических работ:
- Лабораторное оборудование и приемы обращения с ним. Правила безопасной работы в химической лаборатории. 2. Очистка загрязненной поваренной соли.
- Признаки протекания химических реакций.
- Получение кислорода и изучение его свойств. 5. Получение водорода и изучение его свойств.
- Приготовление растворов с определенной массовой долей растворенного вещества.
- Решение экспериментальных задач по теме «Основные классы неорганических соединений». 8. Реакции ионного обмена.
- Качественные реакции на ионы в растворе. 10. Получение аммиака и изучение его свойств.
- Получение углекислого газа и изучение его свойств.
- Решение экспериментальных задач по теме «Неметаллы IV – VII групп и их соединений». 13. Решение экспериментальных задач по теме «Металлы и их соединения».
- ПЛАНИРУЕМЫЕ РЕЗУЛЬТАТЫ Выпускник научится:
- · характеризовать основные методы познания: наблюдение, измерение, эксперимент;
- · описывать свойства твердых, жидких, газообразных веществ, выделяя их существенные признаки;
- · раскрывать смысл основных химических понятий «атом», «молекула», «химический элемент», «простое вещество», «сложное вещество», «валентность», «химическая реакция», используя знаковую систему химии;
- · раскрывать смысл законов сохранения массы веществ, постоянства состава, атомно-молекулярной теории; · различать химические и физические явления;
- · называть химические элементы;
- · определять состав веществ по их формулам;
- · определять валентность атома элемента в соединениях; · определять тип химических реакций;
- · называть признаки и условия протекания химических реакций;
- · выявлять признаки, свидетельствующие о протекании химической реакции при выполнении химического опыта; · составлять формулы бинарных соединений;
- · составлять уравнения химических реакций;
- · соблюдать правила безопасной работы при проведении опытов; · пользоваться лабораторным оборудованием и посудой;
- · вычислять относительную молекулярную и молярную массы веществ;
- · вычислять массовую долю химического элемента по формуле соединения;
- · вычислять количество, объем или массу вещества по количеству, объему, массе реагентов или продуктов реакции; · характеризовать физические и химические свойства простых веществ: кислорода и водорода;
- · получать, собирать кислород и водород;
- · распознавать опытным путем газообразные вещества: кислород, водород; · раскрывать смысл закона Авогадро;
- · раскрывать смысл понятий «тепловой эффект реакции», «молярный объем»; · характеризовать физические и химические свойства воды;
- · раскрывать смысл понятия «раствор»;
- · вычислять массовую долю растворенного вещества в растворе;
- · приготовлять растворы с определенной массовой долей растворенного вещества; · называть соединения изученных классов неорганических веществ;
- · характеризовать физические и химические свойства основных классов неорганических веществ: оксидов, кислот, оснований, солей; · определять принадлежность веществ к определенному классу соединений;
- · составлять формулы неорганических соединений изученных классов;
- · проводить опыты, подтверждающие химические свойства изученных классов неорганических веществ; · распознавать опытным путем растворы кислот и щелочей по изменению окраски индикатора;
- · характеризовать взаимосвязь между классами неорганических соединений; · раскрывать смысл Периодического закона Д.И. Менделеева;
- · объяснять физический смысл атомного (порядкового) номера химического элемента, номеров группы и периода в периодической системе Д.И. Менделеева;
- · объяснять закономерности изменения строения атомов, свойств элементов в пределах малых периодов и главных подгрупп;
- · характеризовать химические элементы (от водорода до кальция) на основе их положения в периодической системе Д.И. Менделеева и особенностей строения их атомов;
- · составлять схемы строения атомов первых 20 элементов периодической системы Д.И. Менделеева; · раскрывать смысл понятий: «химическая связь», «электроотрицательность»;
- · характеризовать зависимость физических свойств веществ от типа кристаллической решетки; · определять вид химической связи в неорганических соединениях;
- · изображать схемы строения молекул веществ, образованных разными видами химических связей;
- · раскрывать смысл понятий «ион», «катион», «анион», «электролиты», «неэлектролиты», «электролитическая диссоциация», «окислитель», «степень окисления» «восстановитель», «окисление», «восстановление»;
- · определять степень окисления атома элемента в соединении; · раскрывать смысл теории электролитической диссоциации;
- · составлять уравнения электролитической диссоциации кислот, щелочей, солей;
- · объяснять сущность процесса электролитической диссоциации и реакций ионного обмена; · составлять полные и сокращенные ионные уравнения реакции обмена;
- · определять возможность протекания реакций ионного обмена;
- · проводить реакции, подтверждающие качественный состав различных веществ; · определять окислитель и восстановитель;
- · составлять уравнения окислительно-восстановительных реакций; · называть факторы, влияющие на скорость химической реакции;
- · классифицировать химические реакции по различным признакам;
- · характеризовать взаимосвязь между составом, строением и свойствами неметаллов;
- · проводить опыты по получению, собиранию и изучению химических свойств газообразных веществ: углекислого газа, аммиака; · распознавать опытным путем газообразные вещества: углекислый газ и аммиак;
- · характеризовать взаимосвязь между составом, строением и свойствами металлов;
- · называть органические вещества по их формуле: метан, этан, этилен, метанол, этанол, глицерин, уксусная кислота, аминоуксусная кислота, стеариновая кислота, олеиновая кислота, глюкоза;
- · оценивать влияние химического загрязнения окружающей среды на организм человека; · грамотно обращаться с веществами в повседневной жизни
- · определять возможность протекания реакций некоторых представителей органических веществ с кислородом, водородом, металлами, основаниями, галогенами.
Выпускник получит возможность научиться:
- · выдвигать и проверять экспериментально гипотезы о химических свойствах веществ на основе их состава и строения, их способности вступать в химические реакции, о характере и продуктах различных химических реакций;
- · характеризовать вещества по составу, строению и свойствам, устанавливать причинно-следственные связи между данными характеристиками вещества;
- · составлять молекулярные и полные ионные уравнения по сокращенным ионным уравнениям;
- · прогнозировать способность вещества проявлять окислительные или восстановительные свойства с учетом степеней окисления элементов, входящих в его состав;
- · составлять уравнения реакций, соответствующих последовательности превращений неорганических веществ различных классов;
- · выдвигать и проверять экспериментально гипотезы о результатах воздействия различных факторов на изменение скорости химической реакции;
- · использовать приобретенные знания для экологически грамотного поведения в окружающей среде;
- · использовать приобретенные ключевые компетенции при выполнении проектов и учебно-исследовательских задач по изучению свойств, способов получения и распознавания веществ;
- · объективно оценивать информацию о веществах и химических процессах;
- · критически относиться к псевдонаучной информации, недобросовестной рекламе в средствах массовой информации; · осознавать значение теоретических знаний по химии для практической деятельности человека;
- · создавать модели и схемы для решения учебных и познавательных задач; понимать необходимость соблюдения предписаний, предлагаемых в инструкциях по использованию лекарств, средств бытовой химии и др.
КРИТЕРИИ И НОРМЫ ОЦЕНКИ ЗНАНИЙ ОБУЧАЮЩИХСЯ
ПО ХИМИИ
- Оценка устного ответа.
Отметка «5» :
- ответ полный и правильный на основании изученных теорий;
- материал изложен в определенной логической последовательности, литературным языком;
- ответ самостоятельный.
Ответ «4» ;
- ответ полный и правильный на сновании изученных теорий;
- материал изложен в определенной логической последовательности, при этом допущены две-три несущественные ошибки, исправленные по требо ванию учителя.
Отметка «З» :
- ответ полный, но при этом допущена существенная ошибка или ответ неполный, несвязный.
Отметка «2» :
- при ответе обнаружено непонимание учащимся основного содержания учебного материала или допущены существенные ошибки, которые уча щийся не может исправить при наводящих вопросах учителя, отсутствие ответа.
Отметка «1» :
- нет никакого ответа учащегося.
- Оценка экспериментальных умений.
- Оценка ставится на основании наблюдения за учащимися и письменного отчета за работу. Отметка «5»:
- работа выполнена полностью и правильно, сделаны правильные наблюдения и выводы;
- эксперимент осуществлен по плану с учетом техники безопасности и правил работы с веществами и оборудованием;
- проявлены организационно - трудовые умения, поддерживаются чистота рабочего места и порядок (на столе, экономно используются реактивы).
Отметка «4» :
- работа выполнена правильно, сделаны правильные наблюдения и выводы, но при этом эксперимент проведен не полностью или допущены несущественные ошибки в работе с веществами и оборудованием.
Отметка «3»:
- работа выполнена правильно не менее чем наполовину или допущена существенная ошибка в ходе эксперимента в объяснении, в оформлении работы, в соблюдении правил техники безопасности на работе с ве ществами и оборудованием, которая исправляется по требованию учителя.
Отметка «2»:
- допущены две (и более) существенные ошибки в ходе: эксперимента, в объяснении, в оформлении работы, в соблюдении правил техники без опасности при работе с веществами и оборудованием, которые учащийся не может исправить даже по требованию учителя;
- работа не выполнена, у учащегося отсутствует экспериментальные умения.
Отметка «1» :
- ученик к работе не приступал, работа не оформлена.
- Оценка умений решать расчетные задачи.
Отметка «5»:
- в логическом рассуждении и решении нет ошибок, задача решена рациональным способом;
Отметка «4»:
- в логическом рассуждении и решения нет существенных ошибок, но задача решена нерациональным способом, или допущено не более двух несущественных ошибок.
Отметка «3»:
- в логическом рассуждении нет существенных ошибок, но допущена существенная ошибка в математических расчетах.
Отметка «2»:
- имеется существенные ошибки в логическом рассуждении и в решении.
- отсутствие ответа на задание.
Отметка «1» :
- ученик к работе не приступал, работа не оформлена.
- Оценка письменных контрольных работ.
Отметка «5»:
- ответ полный и правильный, возможна несущественная ошибка.
Отметка «4»:
- ответ неполный или допущено не более двух несущественных ошибок.
Отметка «3»:
- работа выполнена не менее чем наполовину, допущена одна существен ная ошибка и при этом две-три несущественные.
Отметка «2»:
- работа выполнена меньше чем наполовину или содержит несколько существенных ошибок.
При оценке выполнения письменной контрольной работы необходимо учитывать требования единого орфографического режима.
Отметка «1» :
- ученик к работе не приступал, работа не оформлена.
- Оценка тестовых работ.
Тесты, состоящие из пяти вопросов можно использовать после изучения каждого материала (урока). Тест из 10—15 вопросов используется для периодического контроля. Тест из 20—30 вопросов необходимо использовать для итогового контроля.
При оценивании используется следующая шкала: для теста из пяти вопросов
- • нет ошибок — оценка «5»;
- • одна ошибка - оценка «4»;
- • две ошибки — оценка «З»;
- • три ошибки — оценка «2».
Для теста из 30 вопросов:
- • 25—З0 правильных ответов — оценка «5»;
- • 19—24 правильных ответов — оценка «4»;
- • 13—18 правильных ответов — оценка «З»;
- • меньше 12 правильных ответов — оценка «2».
Отметка «1» :
- ученик к работе не приступал, работа не оформлена.
- Оценка реферата (проекта).
Реферат оценивается по следующим критериям:
Отметка «1» :
- ученик к работе не приступал, работа не оформлена.
Отметка «2»:
- • соблюдение требований к его оформлению, но сама работа не выполнена, либо выполнена менее чем на 50%;
Отметка «3»:
- • соблюдение требований к его оформлению, необходимость и достаточность для раскрытия темы приведенной в тексте реферата информации, но на вопросы по теме реферата ученик не может правильно ответить;
Отметка «4»:
- • соблюдение требований к его оформлению, необходимость и достаточность для раскрытия темы приведенной в тексте реферата информации, умение обучающегося свободно излагать основные идеи, отраженные в реферате;
Отметка «5»:
соблюдение требований к его оформлению, необходимость и достаточность для раскрытия темы приведенной в тексте реферата информации, умение обучающегося свободно излагать основные идеи, отраженные в реферате, способность обучающегося понять суть задаваемых вопросов и сформулировать точные ответы на них.
ВЫПОЛНЕНИЕ ГРУППОВЫХ ПРОЕКТНЫХ РАБОТ ПО ХИМИИ:
Все задания по проектным работам выполняются в сервисе Гугл класс (Google classroom - https://classroom.google.com)/ . Учащиеся распределяются на группы для выполнения проектных работ. Каждый этап работы оценивается оценкой за текущую четверть. Участие в выполнении проектов обязательно для всех учащихся.
1 ЧЕТВЕРТЬ:
- Распределение на группы
- Выбор темы проекта
- Ваш исследовательский проект. Основные вопросы
- Библиография
- Цели и задачи вашего проекта
- Какой эксперимент вам необходимо провести
- Какое оборудование и реактивы необходимы для проведения вашего проекта
2 ЧЕТВЕРТЬ:
- Проведение эксперимента (отчёт по нему)
3 ЧЕТВЕРТЬ:
- Реферат и презентация по проекту
- Защита проекта
- ТЕМАТИЧЕСКОЕ ПЛАНИРОВАНИЕ 8 класс
|
Раздел учебного курса. Количествочасов |
Темы уроков |
Примечание |
|
Введение (3ч) |
1. Предмет химии. Понятия и теории химии. Правила ТБ в кабинете химии |
§ 1, 2 |
|
2. Основные методы познания: наблюдение, измерение, эксперимент. Знаки химических элементов |
§ 21-22 |
|
|
3. Практическая работа № 1 «Лабораторное оборудование и приемы обращения с ним. Правила безопасной работы в химической лаборатории» |
|
|
|
Раздел I. Вещества и химические явления с позиций атомно-молекулярного учения (44 ч): |
||
|
1. Химические элементы и вещества в свете атомно-молекулярного учения (12ч) |
1. Тела и вещества. Физические и химические явления. |
§ 3,4 |
|
2. Атом. Молекула. Химический элемент. Простые и сложные вещества. |
§ 5, 6 |
|
|
3.Атомно-молекулярное учение. Относительная атомная масса |
§ 8,9 |
|
|
4. Закон постоянства состава вещества. Химические формулы. Индексы |
§ 7, 11 |
|
|
5.Относительная молекулярная масса. Массовая доля химического элемента в соединении |
§ 10 |
|
|
6. Вычисление массовой доли химического элемента по формуле соединения. Установление простейшей формулы вещества по массовым долям химических элементов. |
§ 10, 11 |
|
|
7. Система химических элементов Д.И. Менделеева. Группы и периоды периодической системы |
§ 12 |
|
|
8. Валентность |
§ 13, 14 |
|
|
9. Валентность |
§ 13, 14 |
|
|
10. Моль – единица количества вещества. Молярная масса |
§ 15 16 |
|
|
11. Молярный объем газов |
|
|
|
12. Итоговый урок: «Количественные соотношения в химии. Качественный и количественный состав вещества» |
|
|
|
2. Химические реакции. Законы сохранения массы и энергии (7ч) |
1. Условия и признаки протекания химических реакций. Тепловой эффект химических реакций. Понятие об экзо- и эндотермических реакциях |
§ 17 |
|
2. Закон сохранения массы веществ. Химические уравнения. Коэффициенты. |
§18 |
|
|
3. Вычисления по химическим уравнениям количества, объема, массы вещества по количеству, объему, массе реагентов или продуктов реакции. |
§ 19 |
|
|
4. Классификация химических реакций по числу и составу исходных и полученных веществ |
§20 |
|
|
5. Классификация химических реакций по числу и составу исходных и полученных веществ |
§ 20 |
|
|
6. Обобщение по темам: «Атомно-молекулярное учение. Химические реакции» |
§ 3-20 |
|
|
7. Контрольная работа №1 «Атомно-молекулярное учение. Химические реакции» |
|
|
|
3. Вещества в окружающей нас природе и технике (6ч) |
1. Чистые вещества и смеси. Способы разделения смесей |
§ 23 |
|
2. Практическая работа №2 «Очистка веществ» |
|
|
|
3. Растворы. Растворимость веществ в воде. |
§ 24 |
|
|
4. Концентрация растворов. Массовая доля растворенного вещества в растворе. |
§25 |
|
|
5. Расчет массовой доли растворенного вещества в растворе |
|
|
|
|
6. Практическая работа №3 «Приготовление растворов с определенной массовой долей растворенного вещества» |
|
|
4. Понятие о газах. Воздух. Кислород. Горение (7ч) |
1. Состав воздуха. Закон Авогадро. Молярный объем газов. |
§ 26, 27 |
|
2. Вычисления по химическим уравнениям объема вещества по количеству, объему, массе реагентов или продуктов реакции. |
|
|
|
3. Кислород – химический элемент и простое вещество. Получение кислорода. |
§ 28 |
|
|
4. Физические и химические свойства кислорода. |
§ 29 |
|
|
5. Химические свойства кислорода. Применение кислорода |
§ 29 |
|
|
6. Обобщение знаний по теме « Вещества. Воздух. Кислород. Горение» |
|
|
|
7. Контрольная работа №2 « Вещества. Воздух. Кислород. Горение» |
|
|
|
5. Основные классы неорганических соединений (14ч) |
1. Оксиды. Классификация. Номенклатура. Физические свойства оксидов |
§ 30 |
|
2. Оксиды. Классификация. Номенклатура. |
|
|
|
3. Основания. Классификация. Номенклатура. Физические свойства оснований |
§ 31, 36, 37 |
|
|
4. Кислоты. Классификация. Номенклатура. Физические свойства кислот. Получение и применение кислот |
§ 32 |
|
|
5. Соли. Классификация. Номенклатура. Физические свойства солей |
§ 33 |
|
|
6. Химические свойства оксидов. Получение и применение оксидов |
§ 34 |
|
|
7. Химические свойства оксидов |
§ 34 |
|
|
8. Химические свойства оснований. Реакция нейтрализации |
§ 36, 37 |
|
|
9. Химические свойства кислот. Индикаторы. Изменение окраски индикаторов в различных средах. |
§ 35 |
|
|
10. Получение и применение солей. Химические свойства солей |
§ 38 |
|
|
11. Генетическая связь между классами неорганических соединений |
§30-38 |
|
|
12. Практическая работа №4 «Решение экспериментальных задач по теме «Основные классы неорганических соединений». |
|
|
|
13. Обобщение по теме «Основные классы неорганических соединений» |
§30-38 |
|
|
14. Контрольная работа №3 «Основные классы неорганических соединений» |
|
|
|
Раздел II. Химические элементы, вещества и химические реакции в свете электронной теории (23 ч): |
||
|
1. Строение атома (3ч) |
1. Строение атома: ядро, энергетический уровень. Состав ядра атома: протоны, нейтроны. Изотопы |
§ 39 |
|
2. Строение энергетических уровней атомов первых 20 химических элементов периодической системы Д.И. Менделеева. |
§ 40 |
|
|
3. Строение энергетических уровней атомов первых 20 химических элементов периодической системы Д.И. Менделеева. |
§ 40 |
|
|
2. Периодический закон и Периодическая система химических |
1. Периодический закон Д.И. Менделеева. Физический смысл атомного (порядкового) номера химического элемента, номера группы и периода периодической системы. |
§41, 42 |
|
2. Закономерности изменения свойств атомов химических элементов и их соединений на основе |
§ 43 |
|
|
элементов Д.И. Менделеева (3ч) |
положения в периодической системе Д.И. Менделеева и строения атома. Значение Периодического закона Д.И. Менделеева. |
|
|
3. Характеристика химических элементов по положению в периодической системе |
§ 43 |
|
|
3. Строение вещества (4ч) |
1. Электроотрицательность атомов химических элементов. Ковалентная химическая связь: неполярная и полярная. Понятие о водородной связи и ее влиянии на физические свойства веществ на примере воды. |
§44,45 |
|
2. Ионная связь. Металлическая связь. |
§ 46 |
|
|
3. Типы кристаллических решеток (атомная, молекулярная, ионная, металлическая). Зависимость физических свойств веществ от типа кристаллической решетки. |
§ 48 |
|
|
4. Степень окисления. Определение степени окисления атомов химических элементов в соединениях. |
§ 47 |
|
|
4. Химические реакции в свете электронной теории (4ч) |
1. Окислитель. Восстановитель. Классификация химических реакций по изменению степеней окисления атомов химических элементов. Сущность окислительно-восстановительных реакций. |
§ 49, 51 |
|
2. Составление окислительно-восстановительных реакций |
§ 50 |
|
|
3. Обобщение по темам: «Периодический закон. Строение вещества. Химические реакции в свете электронной теории» |
§41-50 |
|
|
4. Контрольная работа №4 «Периодический закон. Строение вещества. Химические реакции в свете электронной теории» |
|
|
|
5. Водород — рождающий воду и энергию (3ч) |
1. Водород – химический элемент и простое вещество. Физические и химические свойства водорода. |
§ 52 |
|
2. Получение водорода в лаборатории. Получение водорода в промышленности. Применение водорода. |
§ 52 |
|
|
3. Вода в природе. Круговорот воды в природе. Физические и химические свойства воды. |
§ 53 |
|
|
6. Галогены (3ч) |
1. Галогены: физические и химические свойства. |
§ 54 |
|
2. Галогены: физические и химические свойства. |
§ 54 |
|
|
3. Соединения галогенов: хлороводород, хлороводородная кислота и ее соли |
§ 55 |
|
|
7. Резервное время (2ч) |
1. Решение задач |
|
|
|
2. Решение задач |
|
ТЕМАТИЧЕСКОЕ ПЛАНИРОВАНИЕ 9 класс
|
Раздел учебного курса. Количествочасов |
Темы уроков |
Примечание |
|||
|
|
Повторение основных вопросов курса 8 класса и введение в курс 9 класса (5ч) |
|
1. Строение атома. Характеристика химического элемента по его положению в Периодической системе Д.И. Менделеева |
|
|
|
2. Характеристика химического элемента по его положению в Периодической системе Д.И. Менделеева |
|
||||
|
|
|||||
|
3. Характеристика химического элемента по кислотно-основным свойствам, образуемых ими соединениям |
|
||||
|
4. Сущность окислительно-восстановительных реакции |
|
||||
|
5. Окислительно-восстановительные реакции |
|
||||
|
Раздел I. Теоретические ос |
новы химии (13ч): |
||||
|
Тема 1. Химические реакции. Теория электролитической диссоциации. (13ч) |
|
1. Понятие о скорости химической реакции. Факторы, влияющие на скорость химической реакции. Понятие о катализаторе. Классификация химических реакций по различным признакам |
§ 1,2 |
||
|
2. Ионы. Катионы и анионы. |
§ 3,4 |
||||
|
3. Электролитическая диссоциация. Электролиты и неэлектролиты. |
§ 5,6 |
||||
|
4. Электролитическая диссоциация кислот, щелочей и солей. |
§ 8 |
||||
|
5. Сильные и слабые электролиты |
§ 7 |
||||
|
|
6. Реакции ионного обмена. Условия протекания реакций ионного обмена. |
§ 8 |
|||
|
7. Реакции ионного обмена. Условия протекания реакций ионного обмена. |
§ 8 |
||||
|
8. Кислоты как электролиты |
§9 |
||||
|
9. Основания как электролиты |
§ 10 |
||||
|
|
10. Соли как электролиты |
§ 11 |
|||
|
11. Практическая работа №1 «Реакции ионного обмена» |
§ |
||||
|
12. Обобщение по теме «Химические реакции. Электролитическая диссоциация» |
§1-11 |
||||
|
13. Контрольная работа №1 «Химические реакции. Электролитическая диссоциация» |
|
||||
|
Раздел II. Элементы-немет |
аллы и их важнейшие соединения (22ч): |
||||
|
Тема 2.Общая характеристика неметаллов и их соединений (2ч) |
|
1. Положение неметаллов в периодической системе химических элементов Д.И. Менделеева. Общие свойства неметаллов. |
§ 12,13,14 |
||
|
2. Неметаллы, изученные за курс 8 класса: водород, галогены. Качественные реакции на галоген-ионы. |
записи |
||||
|
Тема 3. Подгруппа кислорода и ее типичные представители (5ч) |
1. Общая характеристика элементов подгруппы. Кислород. Озон. |
§ 15,16 |
|||
|
2. Сера: физические и химические свойства. Соединения серы: сероводород, сульфиды, оксиды серы. |
§ 17-19 |
||||
|
3. Серная, сернистая и сероводородная кислоты и их соли. |
§ 20 |
||||
|
4. Качественные реакции на сульфат-, сульфит- и сульфид-ионы. |
записи |
||||
|
|
5. Контрольная работа №2 «Подгруппа кислорода» |
|
|
Тема 4. Подгруппа азота и ее типичные представители (8ч) |
1. Азот: физические и химические свойства. Аммиак. Соли аммония. |
§21-23 |
|
2. Практическая работа №2 «Получение аммиака и опыты с ним» |
|
|
|
3. Оксиды азота. Азотная кислота и ее соли. |
§ 24,25 |
|
|
4. Фосфор: физические и химические свойства. Соединения фосфора: оксид фосфора (V), ортофосфорная кислота и ее соли. |
§ 26.27 |
|
|
5. Обобщение по теме «Подгруппа азота и ее типичные представители» |
§21-27 |
|
|
6. Проведение расчетов на основе формул и уравнений реакций: массовой доли химического элемента в веществе, массовой доли растворенного вещества в растворе |
|
|
|
7. Проведение расчетов на основе формул и уравнений реакций: массовой доли растворенного вещества в растворе |
|
|
|
8. Проведение расчетов на основе формул и уравнений реакций: массовой доли растворенного вещества в растворе |
|
|
|
Тема 5. Подгруппа углерода (7ч) |
1. Углерод: физические и химические свойства. Аллотропия углерода: алмаз, графит, карбин, фуллерены. |
§28,29,30 |
|
2. Соединения углерода: оксиды углерода (II) и (IV), угольная кислота и ее соли. |
§31,32,33 |
|
|
3. Практическая работа №2 «Получение углекислого газа и изучение его свойств. Распознавание карбонатов» |
|
|
|
4. Кремний и его соединения. |
§34 |
|
|
5. Основные методы познания: наблюдение, измерение, эксперимент. Качественные реакции. |
|
|
|
6. Практическая работа №3 «Решение экспериментальных задач по теме «Неметаллы IV – VII групп и их соединений». |
|
|
|
7. Решение задач. Вычисления по химическим уравнениям количества, объема, массы вещества по количеству, объему, массе реагентов или продуктов реакции. |
|
|
|
Раздел III. Элементы-металлы (10ч): |
||
|
Тема 6 Общие свойства металлов (10ч) |
1. Положение металлов в периодической системе химических элементов Д.И. Менделеева. Металлы в природе и общие способы их получения. Общие физические свойства металлов. |
|
|
2. Общие химические свойства металлов: реакции с неметаллами, кислотами, солями. Электрохимический ряд напряжений металлов. |
|
|
|
3. Общие химические свойства металлов: реакции с неметаллами, кислотами, солями. Электрохимический ряд напряжений металлов. |
|
|
|
4. Общие химические свойства металлов: реакции с неметаллами, кислотами, солями. |
|
|
|
5. Сплавы. Коррозия металлов и сплавов |
|
|
|
6. Щелочные металлы и их соединения. Щелочноземельные металлы и их соединения. |
|
|
|
7. Алюминий. Амфотерность оксида и гидроксида алюминия. |
|
|
|
8 Железо. Соединения железа и их свойства: оксиды, гидроксиды и соли железа (II и III). |
|
|
|
9. Обобщение по теме: «Металлы» |
|
|
|
|
10. Контрольная работа №3 «Металлы» |
|
|
|
Раздел IV. Общие сведения об органических соединениях (13ч): |
|||
|
Тема 7 Органические вещества (12ч) |
1. Первоначальные сведения о строении органических веществ. |
|
|
|
|
2. Углеводороды: метан, этан и другие члены гомологического ряда |
|
|
|
|
3. Изомерия и номенклатура |
|
|
|
|
4. Практическая работа №4 «Особенности состава и строения органических соединений» |
|
|
|
|
4. Непредельные углеводороды: этилен |
|
|
|
|
5. Непредельные этиленовые углеводороды |
|
|
|
|
6. Непредельные углеводороды: ацетилен |
|
|
|
|
7. Непредельные ацетиленовые углеводороды |
|
|
|
|
8. Источники углеводородов: природный газ, нефть, уголь |
|
|
|
|
9. Кислородсодержащие соединения: спирты (метанол, этанол, глицерин) |
|
|
|
|
10. Кислородсодержащие соединения: карбоновые кислоты (уксусная кислота, аминоуксусная кислота, стеариновая и олеиновая кислоты |
|
|
|
|
11. Биологически важные вещества: жиры, глюкоза, белки. |
|
|
|
|
|
12. Репетиционное тестирование для учащихся, выбравших химию для ОГЭ |
|
|
Раздел V. Химия и жизнь (3ч): |
|||
|
Тема 8 Человек в мире веществ (3ч) |
1. Химическое загрязнение окружающей среды и его последствия |
|
|
|
2. Полимеры и жизнь |
|
||
|
3. Химия и здоровье человека |
|
||
|
Повторение (4ч) |
|||
|
|
1. Повторение. Строение атома и Периодический закон |
|
|
|
2. Повторение. Строение молекул. Химическая связь. |
|
||
|
3. Повторение. Основные классы неорганических веществ |
|
||
|
4. Повторение. Основные классы неорганических веществ |
|
||
|
Резервное время (1ч) |
1 Решение задач |
|
|
|
|
|
|
|
- Календарно-тематическое планирование 8 класс
|
Раздел |
Характеристика основных видов деятельности ученика (на уровне учебных действий) |
Темы уроков |
|
|
|
Введение |
Использовать межпредметные связи. Знакомиться с лабораторным оборудованием. Наблюдать демонстрируемые и самостоятельно проводимые опыты. Описывать свойства изучаемых веществ на основе наблюдений за их превращениями. Учиться проводить химический эксперимент. Соблюдать технику безопасности. Использовать метод сравнения при характеристике свойств веществ |
1. Предмет химии. Понятия и теории химии. Правила ТБ в кабинете химии |
|
|
|
|
2. Основные методы познания: наблюдение, измерение, эксперимент. Знаки химических элементов |
|
|
|
|
3. Практическая работа № 1 «Лабораторное оборудование и приемы обращения с ним. Правила безопасной работы в химической лаборатории» |
|
|
||
|
Раздел I. Вещества и химические явления с позиций атомно-молекулярного учения: |
||||
|
Химические |
Устанавливать межпредметные связи. Различать тела и вещества. Различать понятия «атом», «молекула», «химический элемент». Описывать физические и химические явления. Сравнивать свойства веществ. Наблюдать свойства веществ. Сравнивать физические и химические явления. Сопоставлять простые и сложные вещества. Определять валентность атомов в бинарных соединениях. Уметь пользоваться Периодической системой химических элементов Д.И. Менделеева при определении валентности. Описывать состав простейших соединений по их химическим формулам. Составлять формулы бинарных соединений по известной валентности атомов. Моделировать строение молекул метана, аммиака, водорода, хлороводорода. Пользоваться информацией из других источников для подготовки кратких сообщений. Готовить компьютерные |
1. Тела и вещества. Физические и химические явления. |
|
|
|
элементы и вещества в |
2. Атом. Молекула. Химический элемент. Простые и сложные вещества. |
|
|
|
|
свете атомно-молекулярного |
3.Атомно-молекулярное учение. Относительная атомная масса |
|
|
|
|
учения |
4. Закон постоянства состава вещества. Химические формулы. Индексы |
|
|
|
|
5.Относительная молекулярная масса. Массовая доля химического элемента в соединении |
|
|
||
|
|
6. Вычисление массовой доли химического элемента по формуле соединения. Установление простейшей формулы вещества по массовым долям химических элементов. |
|
|
|
|
|
7. Система химических элементов Д.И. Менделеева. Группы и периоды периодической системы |
|
|
|
|
|
8. Валентность |
|
|
|
|
|
9. Валентность |
|
|
|
|
|
10. Моль – единица количества вещества. Молярная масса |
|
|
|
|
11. Молярный объем |
|
|
||
|
12. Итоговый урок: «Количественные соотношения в химии. Качественный и количественный состав вещества» |
|
|
||
|
|
презентации по теме. Рассчитывать относительную молекулярную массу по формулам веществ. Рассчитывать массовую долю химического элемента в соединении. Рассчитывать молярную массу вещества. Устанавливать простейшие формулы веществ по массовым долям элементов |
|
|
|
|
Химические реакции. Законы |
Описывать простейшие химические реакции с помощью химических уравнений. Классифицировать химические реакции. Актуализировать знания о признаках химических реакций. Составлять классификационные и сравнительные таблицы и схемы, опорные конспекты. Вычислять по химическим уравнениям массу или количество вещества по известной массе или количеству вещества одного из вступающих или получающихся в реакции веществ. |
1. Условия и признаки протекания химических реакций. Тепловой эффект химических реакций. Понятие об экзо- и эндотермических реакциях. |
|
|
|
сохранения массы и энергии |
2. Закон сохранения массы веществ. Химические уравнения. Коэффициенты. |
|
|
|
|
3. Вычисления по химическим уравнениям количества, объема, массы вещества по количеству, объему, массе реагентов или продуктов реакции. |
|
|
||
|
4. Классификация химических реакций по числу и составу исходных и полученных веществ |
|
|
||
|
|
5. Классификация химических реакций по числу и составу исходных и полученных веществ |
|
|
|
|
6. Обобщение по темам: «Атомно-молекулярное учение. Химические реакции» |
|
|
||
|
|
7. Контрольная работа №1 «Атомно-молекулярное учение. Химические реакции» |
|
|
|
|
Вещества в |
Устанавливать межпредметные связи. Учиться проводить химический эксперимент. Наблюдать превращения изучаемых веществ. Описывать свойства веществ и смесей в ходе демонстрационного и лабораторного экспериментов. Сравнивать чистые вещества и смеси. Уметь разделять смеси. Проводить очистку веществ отстаиванием, фильтрованием, выпариванием. Делать выводы из результатов проведённых химических опытов. Составлять классификационные схемы. Применять символико-графические средства наглядности. Вычислять массовую долю растворённого вещества в растворе. |
1. Чистые вещества и смеси. Способы разделения смесей |
|
|
|
окружающей |
2. Практическая работа №2 «Очистка веществ» |
|
|
|
|
нас природе и |
3. Растворы. Растворимость веществ в воде. |
|
|
|
|
технике |
4. Концентрация растворов. Массовая доля растворенного вещества в растворе. |
|
|
|
|
|
5. Расчет массовой доли растворенного вещества в растворе |
|
|
|
|
|
6. Практическая работа №3 «Приготовление растворов с определенной массовой долей растворенного вещества» |
|
|
|
|
Приготавливать растворы заданной концентрации. Пользоваться информацией из других источников для подготовки кратких сообщений. Готовить компьютерные презентации по теме |
|
|
|
|
Понятие о |
Использовать межпредметные связи. Использовать примеры решения типов задач, задачники с приведёнными в них алгоритмами решения задач. Обобщать и систематизировать знания об изученных веществах. Учиться решать исследовательским путём поставленную проблему. Наблюдать превращения изучаемых веществ. Описывать свойства веществ в ходе демонстрационного и лабораторного экспериментов. Учиться раскрывать причинно-следственную связь между физическими свойствами изучаемого вещества и способами его собирания. Применять полученные знания при проведении химического эксперимента. Устанавливать связь между свойствами вещества и его применением. Отбирать необходимую информацию из разных источников. Готовить компьютерные презентации по теме |
1. Состав воздуха. Закон Авогадро. Молярный объем газов. |
|
|
|
газах. Воздух. Кислород. Горение |
2. Вычисления по химическим уравнениям объема вещества по количеству, объему, массе реагентов или продуктов реакции. |
|
|
|
|
3. Кислород – химический элемент и простое вещество. Получение кислорода. |
|
|
||
|
4. Физические и химические свойства кислорода. |
|
|
||
|
5. Химические свойства кислорода. Применение кислорода |
|
|
||
|
6. Обобщение знаний по теме « Вещества. Воздух. Кислород. Горение» |
|
|
||
|
7. Контрольная работа №2 « Вещества. Воздух. Кислород. Горение» |
|
|
||
|
Основные классы |
Исследовать свойства изучаемых веществ. Наблюдать физические и химические превращения изучаемых веществ. Описывать химические реакции, наблюдаемые в ходе демонстрационного и лабораторного экспериментов. Делать выводы из результатов проведённых химических опытов. Классифицировать изучаемые вещества. Составлять формулы оксидов, кислот, оснований, солей. |
1. Оксиды. Классификация. Номенклатура. Физические свойства оксидов |
|
|
|
неорганических |
2. Оксиды. Классификация. Номенклатура. |
|
|
|
|
соединений |
3. Основания. Классификация. Номенклатура. Физические свойства оснований |
|
|
|
|
4. Кислоты. Классификация. Номенклатура. Физические свойства кислот. Получение и применение кислот |
|
|
||
|
|
5. Соли. Классификация. Номенклатура. Физические свойства солей |
|
|
|
|
|
6. Химические свойства оксидов. Получение и применение |
|
|
|
|
Характеризовать состав и свойства веществ основных классов неорганических соединений. Записывать уравнения химических реакций. Осуществлять генетическую связь между классами неорганических соединений |
оксидов |
|
|
|
|
7. Химические свойства оксидов |
|
|
|
|
|
8. Химические свойства оснований. Реакция нейтрализации |
|
|
|
|
9. Химические свойства кислот. Индикаторы. Изменение окраски индикаторов в различных средах. |
|
|
||
|
10. Получение и применение солей. Химические свойства солей |
|
|
||
|
11. Генетическая связь между классами неорганических соединений |
|
|
||
|
12. Практическая работа №4 «Решение экспериментальных задач по теме «Основные классы неорганических соединений». |
|
|
||
|
13. Обобщение по теме «Основные классы неорганических соединений» |
|
|
||
|
|
14. Контрольная работа №3 «Основные классы неорганических соединений» |
|
|
|
|
Раздел II. Химические элементы, вещества и химические реакции в свете электронной теории |
||||
|
Строение атома |
Использовать межпредметные связи. Моделировать строение атома. Определять понятия «химический элемент», «порядковый номер», «массовое число», «изотоп», «относительная атомная масса», «электронная оболочка», «электронный слой». Делать умозаключения о характере изменения свойств химических элементов с увеличением зарядов атомных ядер. Пользоваться информацией из других источников для подготовки кратких сообщений. |
1. Строение атома: ядро, энергетический уровень. Состав ядра атома: протоны, нейтроны. Изотопы |
|
|
|
|
2. Строение энергетических уровней атомов первых 20 химических элементов периодической системы Д.И. Менделеева. |
|
|
|
|
3. Строение энергетических уровней атомов первых 20 химических элементов периодической системы Д.И. Менделеева. |
|
|
||
|
Периодический закон и Периодическая система химических элементов Д.И. Менделеева |
Классифицировать изученные химические элементы и их соединения. Сравнивать свойства веществ, принадлежащих к разным классам; химические элементы разных групп. Устанавливать внутри- и межпредметные связи. Описывать и характеризовать структуру таблицы «Периодическая система химических |
1. Периодический закон Д.И. Менделеева. Физический смысл атомного (порядкового) номера химического элемента, номера группы и периода периодической системы. |
|
|
|
2. Закономерности изменения свойств атомов химических элементов и их соединений на основе положения в периодической системе Д.И. Менделеева и строения атома. Значение Периодического закона Д.И. Менделеева. |
|
|
||
|
|
элементов Д.И. Менделеева» (короткая форма). Различать периоды, группы, главные и побочные подгруппы. Характеризовать химические элементы по положению в Периодической системе Д.И. Менделеева. Структурировать материал о жизни и деятельности Д.И. Менделеева, об утверждении учения о периодичности. Отбирать информацию из других источников для подготовки кратких сообщений. |
3. Характеристика химических элементов по положению в периодической системе |
|
|
|
Строение вещества |
Разграничивать понятия «химическая связь», «кристаллическая решётка». Обобщать понятия «ковалентная неполярная связь», «ковалентная полярная связь», «ионная связь», «ионная кристаллическая решётка», «атомная кристаллическая решётка», «молекулярная кристаллическая решётка». Уметь составлять схемы образования веществ с различными видами химической связи. Уметь характеризовать свойства вещества, зная его кристаллическую решётку. Моделировать строение веществ с ковалентной и ионной связью. Определять степень окисления элементов. Составлять формулы веществ по степени окисления элементов |
1. Электроотрицательность атомов химических элементов. Ковалентная химическая связь: неполярная и полярная. Понятие о водородной связи и ее влиянии на физические свойства веществ на примере воды. |
|
|
|
|
2. Ионная связь. Металлическая связь. |
|
|
|
|
3. Типы кристаллических решеток (атомная, молекулярная, ионная, металлическая). Зависимость физических свойств веществ от типа кристаллической решетки. |
|
|
||
|
|
4. Степень окисления. Определение степени окисления атомов химических элементов в соединениях. |
|
|
|
|
Химические реакции в свете электронной теории |
Обобщать понятия «окислитель», «окисление», «восстановитель», «восстановление». Распознавать уравнения окислительно-восстановительных реакций. Расставлять коэффициенты методом электронного баланса. Устанавливать внутри- и межпредметные связи. Составлять классификационные схемы, сравнительные и обобщающие таблицы |
1. Окислитель. Восстановитель. Классификация химических реакций по изменению степеней окисления атомов химических элементов. Сущность окислительно-восстановительных реакций. |
|
|
|
2. Составление окислительно-восстановительных реакций |
|
|
||
|
|
3. Обобщение по темам: «Периодический закон. Строение вещества. Химические реакции в свете электронной теории» |
|
|
|
|
4. Контрольная работа №4 «Периодический закон. Строение вещества. Химические реакции в свете |
|
|
|
|
|
электронной теории» |
|
|
|
Водород — рождающий |
Наблюдать превращения изучаемых веществ. Описывать свойства веществ в ходе демонстрационного и лабораторного экспериментов. Соблюдать правила техники безопасности. Учиться раскрывать причинно-следственную зависимость между физическими свойствами изучаемого вещества и способами его собирания. Применять полученные знания при проведении химического эксперимента. Устанавливать связь между свойствами вещества и его применением. Отбирать необходимую информацию из других источников Наблюдать превращения изучаемых веществ. |
1. Водород – химический элемент и простое вещество. Физические и химические свойства водорода. |
|
|
|
воду и энергию |
2. Получение водорода в лаборатории. Получение водорода в промышленности. Применение водорода. |
|
|
|
|
3. Вода в природе. Круговорот воды в природе. Физические и химические свойства воды. |
|
|
||
|
Галогены |
Использовать знания для составления характеристики естественного семейства галогенов. Наблюдать превращения изучаемых веществ. Описывать свойства веществ в ходе демонстрационного и лабораторного экспериментов. Устанавливать связь между свойствами вещества и его применением. Устанавливать внутри- и межпредметные связи |
1. Галогены: физические и химические свойства. |
|
|
|
|
2. Галогены: физические и химические свойства. |
|
|
|
|
|
3. Соединения галогенов: хлороводород, хлороводородная кислота и ее соли |
|
|
|
|
Резервное |
Использовать примеры решения типов задач, задачники с приведёнными в них алгоритмами решения задач. Обобщать и систематизировать знания об изученных веществах. Учиться решать исследовательским путём поставленную проблему. |
1. Решение задач |
|
|
|
время |
2. Решение задач |
|
|
Календарно-тематическое планирование 9 класс
|
Раздел |
Характеристика основных видов деятельности ученика (на уровне учебных действий) |
Темы уроков |
|
|
||||
|
|
Повторение основных вопросов курса 8 класса и введение в курс 9 класса |
|
Знать: - важнейшие химические понятия: химический элемент, атом, молекула, относительная атомная и молекулярная массы; - химические свойства основных классов неорганических веществ;
Уметь: -объяснять физический смысл атомного порядкового номера химического элемента, номеров группы, периода, к которым элемент принадлежит в Периодической системе Д.И. Менделеева; закономерности изменения свойств элементов в пределах малых периодов и главных подгрупп; - составлять электронный баланс для ОВР; - определять окислитель и восстановитель; - составлять формулы неорганических соединений изученных классов, уравнения химических реакций |
|
1. Строение атома. Характеристика химического элемента по его положению в Периодической системе Д.И. Менделеева |
|
|
|
|
|
2. Характеристика химического элемента по его положению в Периодической системе Д.И. Менделеева |
|
|
|||||
|
|
||||||||
|
|
3. Характеристика химического элемента по кислотно-основным свойствам, образуемых ими соединениям |
|
|
|||||
|
|
4. Сущность окислительно-восстановительных реакции |
|
|
|||||
|
|
5. Окислительно-восстановительные реакции |
|
|
|||||
|
|
|
|
||||||
|
|
||||||||
|
Раздел I. Теоретические о |
сновы химии |
|||||||
|
Тема 1. Химические реакции. Теория электролитической диссоциации. |
|
Знать: - называть признаки и условия протекания химических реакций; - понятия: ион, катион, анион, электролитическая диссоциация, электролит, неэлектролиты, сильный и слабый электролит Уметь: - выявлять признаки, свидетельствующие о протекании химической реакции при выполнении химического опыта; - называть факторы, влияющие на скорость химической реакции; |
1. Понятие о скорости химической реакции. Факторы, влияющие на скорость химической реакции. Понятие о катализаторе. Классификация химических реакций по различным признакам |
|
|
|||
|
2. Ионы. Катионы и анионы. |
|
|
||||||
|
3. Электролитическая диссоциация. Электролиты и неэлектролиты. |
|
|
||||||
|
4. Электролитическая диссоциация кислот, щелочей и солей. |
|
|
||||||
|
5. Сильные и слабые электролиты |
|
|
||||||
|
6. Реакции ионного обмена. Условия |
|
|
||||||
|
|
- раскрывать смысл теории электролитической диссоциации; - составлять уравнения электролитической диссоциации кислот, щелочей, солей; - объяснять сущность процесса электролитической диссоциации и реакций ионного обмена; - составлять полные и сокращенные ионные уравнения реакции обмена; - определять возможность протекания реакций ионного обмена; - объективно оценивать информацию о веществах и химических процессах |
протекания реакций ионного обмена. |
|
|
||
|
7. Реакции ионного обмена. Условия протекания реакций ионного обмена. |
|
|
||||
|
8. Кислоты как электролиты |
|
|
||||
|
9. Основания как электролиты |
|
|
||||
|
10. Соли как электролиты |
|
|
||||
|
11. Практическая работа №1 «Реакции ионного обмена» |
|
|
||||
|
12. Обобщение по теме «Химические реакции. Электролитическая диссоциация» |
|
|
||||
|
13. Контрольная работа №1 «Химические реакции. Электролитическая диссоциация» |
|
|
||||
|
Раздел II. Элементы-неметаллы и их важнейшие соединения |
||||||
|
Тема 2.Общая характеристика неметаллов и их соединений |
|
Знать: |
1. Положение неметаллов в периодической системе химических элементов Д.И. Менделеева. Общие свойства неметаллов. |
|
|
|
|
Знать: - положение неметаллов в ПСХЭ Д.И. Менделеева; строение атомов неметаллов, физические свойства Уметь: - характеризовать свойства неметаллов; - давать характеристику элементам-неметаллам на основании их положения в ПСХЭ; -сравнивать неметаллы с металлами - характеризовать химический элементы водород, галогены по их положению в ПСХЭ; - составлять уравнения реакций (ОВР) химических свойств водорода, галогенов; - распознавать опытным путем раствор соляной кислоты и ее солей. |
||||||
|
2. Неметаллы, изученные за курс 8 класса: водород, галогены. Качественные реакции на галоген-ионы. |
|
|
||||
|
Тема 3. Подгруппа кислорода и ее типичные представители |
|
Знать: - особенности строения атомов подгруппы; - свойства серной кислоты в свете представлений ТЭД; -окислительные свойства концентрированной серной кислоты в свете ОВР;
Уметь; - характеризовать взаимосвязь между составом, |
1. Общая характеристика элементов подгруппы. Кислород. Озон. |
|
|
|
|
2. Сера: физические и химические свойства. Соединения серы: сероводород, сульфиды, оксиды серы. |
|
|
||||
|
3. Серная, сернистая и сероводородная кислоты и их соли. |
|
|
||||
|
4. Качественные реакции на сульфат-, сульфит- и сульфид-ионы. |
|
|
||||
|
|
строением и свойствами неметаллов; - проводить качественную реакцию на сульфат -ион -записывать уравнения реакций в ионном виде и с точки зрения ОВР |
5. Контрольная работа №2 «Подгруппа кислорода» |
|
|
|
Тема 4. Подгруппа азота и ее типичные представители |
Знать: - особенности строения атомов подгруппы; - свойства азотной кислоты в свете представлений ТЭД; -окислительные свойства раствора и концентрированной азотной кислоты в свете ОВР; - качественные реакции на аммиак, соединения азотной и фосфорной кислот.
Уметь; - проводить качественную реакцию на нитрат- и фосфат-ионы -записывать уравнения реакций в ионном виде и с точки зрения ОВР; - изучению химических свойств газообразных веществ: аммиака; - осознавать значение теоретических знаний по химии для практической деятельности человека; - создавать модели и схемы для решения учебных и познавательных задач; понимать необходимость соблюдения предписаний, предлагаемых в инструкциях по использованию лекарств, средств бытовой химии и др. |
1. Азот: физические и химические свойства. Аммиак. Соли аммония. |
|
|
|
2. Практическая работа №2 «Получение аммиака и опыты с ним» |
|
|
||
|
3. Оксиды азота. Азотная кислота и ее соли. |
|
|
||
|
4. Фосфор: физические и химические свойства. Соединения фосфора: оксид фосфора (V), ортофосфорная кислота и ее соли. |
|
|
||
|
5. Обобщение по теме «Подгруппа азота и ее типичные представители» |
|
|
||
|
6. Проведение расчетов на основе формул и уравнений реакций: массовой доли химического элемента в веществе, массовой доли растворенного вещества в растворе |
|
|
||
|
7. Проведение расчетов на основе формул и уравнений реакций: массовой доли растворенного вещества в растворе |
|
|
||
|
8. Проведение расчетов на основе формул и уравнений реакций: массовой доли растворенного вещества в растворе |
|
|
||
|
Тема 5. Подгруппа углерода |
Знать: - особенности строения атомов подгруппы; - свойства угольной и кремниевой кислот в свете представлений ТЭД; - качественные реакции на соединения угольной и кремниевой кислот. Уметь; - проводить качественную реакцию на карбонат- и силикат-ионы -записывать уравнения реакций в ионном виде и с точки зрения ОВР |
1. Углерод: физические и химические свойства. Аллотропия углерода: алмаз, графит, карбин, фуллерены. |
|
|
|
2. Соединения углерода: оксиды углерода (II) и (IV), угольная кислота и ее соли. |
|
|
||
|
3. Практическая работа №2 «Получение углекислого газа и изучение его свойств. Распознавание карбонатов» |
|
|
||
|
4. Кремний и его соединения. |
|
|
||
|
5. Основные методы познания: наблюдение, измерение, эксперимент. |
|
|
|
|
- проводить опыты по получению, собиранию и изучению химических свойств газообразных веществ: углекислого газа, ; - распознавать опытным путем газообразные вещества (углекислый газ) и растворы веществ; |
Качественные реакции. |
|
|
|
6. Практическая работа №3 «Решение экспериментальных задач по теме «Неметаллы IV – VII групп и их соединений». |
|
|
||
|
7. Решение задач. Вычисления по химическим уравнениям количества, объема, массы вещества по количеству, объему, массе реагентов или продуктов реакции. |
|
|
||
|
Раздел III. Элементы-металлы |
||||
|
Тема 6. Общие свойства металлов |
Знать: - положение элементов металлов в ПС; - физические свойства металлов; пластичность, электро-и теплопроводность, металлический блеск, твердость, плотность; -общие химические свойства металлов: взаимодействие с неметаллами, водой, кислотами, солями; - классификацию сплавов на основе черных (чугун и сталь) и цветных металлов, характеристику физических свойств Ме; - причины и виды коррозии металлов. Уметь: -характеризовать металлы на основе их в Периодической системе Д.И. Менделеева и особенностей строения их атомов; - использовать приобретенные знания и умения в практической деятельности и повседневной жизни: для безопасного обращения с металлами; экологически грамотного поведения в окружающей среде; критической оценки информации о веществах, используемых в быту; -записывать уравнения химических реакций взаимодействия с неметаллами, кислотами, солями, используя электрохимический ряд металлов для химических свойств; |
1. Положение металлов в периодической системе химических элементов Д.И. Менделеева. Металлы в природе и общие способы их получения. Общие физические свойства металлов. |
|
|
|
2. Общие химические свойства металлов: реакции с неметаллами, кислотами, солями. Электрохимический ряд напряжений металлов. |
|
|
||
|
3. Общие химические свойства металлов: реакции с неметаллами, кислотами, солями. Электрохимический ряд напряжений металлов. |
|
|
||
|
4. Общие химические свойства металлов: реакции с неметаллами, кислотами, солями. |
|
|
||
|
5. Сплавы. Коррозия металлов и сплавов |
|
|
||
|
6. Щелочные металлы и их соединения. Щелочноземельные металлы и их соединения. |
|
|
||
|
7. Алюминий. Амфотерность оксида и гидроксида алюминия. |
|
|
||
|
8 Железо. Соединения железа и их свойства: оксиды, гидроксиды и соли железа (II и III). |
|
|
||
|
9. Обобщение по теме: «Металлы» |
|
|
||
- описывать свойства и области применения различных металлов и сплавов;
- объяснять и применять доступные способы защиты от коррозии металлов в быту
Раздел IV. Общие сведения об органических соединениях Знать:
- особенности органических соединений;
- валентность и степень окисления элементов в соединениях;
- понятия: предельные углеводороды, гомологический ряд предельных углеводородов, изомерия;
- иметь представление о биологически важных органических веществах: жирах как сложных эфирах глицерина и жирных кислот
Уметь:
определять изомеры и гомологи.
|
Тема 7. Органические записывать структурные формулы изомеров и вещества - давать названия изученным веществам.
- называть изученные вещества;
- характеризовать химические свойства органических соединений
- характеризовать типичные свойства уксусной кислоты;
- использовать приобретенные знания для экологически грамотного поведения в окружающей среде;
- использовать приобретенные ключевые компетенции при выполнении проектов и учебно-исследовательских задач по изучению свойств, способов получения и распознавания веществ
Раздел V. Химия и жизнь Уметь:
- объективно оценивать информацию о веществах и химических процессах;
- критически относиться к псевдонаучной информации, недобросовестной рекламе в средствах
- Контрольная работа №3 «Металлы»
- Первоначальные сведения о строении органических веществ.
- Углеводороды: метан, этан и другие члены гомологического ряда
- Изомерия и номенклатура
- Практическая работа №4 «Особенности состава и строения органических соединений»
- Непредельные углеводороды: этилен
- Непредельные этиленовые углеводороды
- Непредельные углеводороды: ацетилен 7. Непредельные ацетиленовые углеводороды
- Источники углеводородов: природный газ, нефть, уголь
- Кислородсодержащие соединения: спирты (метанол, этанол, глицерин) 10. Кислородсодержащие соединения:
карбоновые кислоты (уксусная кислота, аминоуксусная кислота, стеариновая и олеиновая кислоты
- Биологически важные вещества: жиры, глюкоза, белки.
- Репетиционное тестирование для учащихся, выбравших химию для ОГЭ
- Химическое загрязнение окружающей среды и его последствия
- Полимеры и жизнь
- Химия и здоровье человека
|
|
|
массовой информации; - осознавать значение теоретических знаний по химии для практической деятельности человека; создавать модели и схемы для решения учебных и познавательных задач; -понимать необходимость соблюдения предписаний, предлагаемых в инструкциях по использованию лекарств, средств бытовой химии и др. |
|
|
|
|
Повторение. |
|||||
|
|
|
1. Повторение. Строение атома и Периодический закон |
|
|
|
|
|
|
|
2. Повторение. Строение молекул. Химическая связь. |
|
|
|
|
|
3. Повторение. Основные классы неорганических веществ |
|
|
|
|
|
|
|
4. Повторение. Основные классы неорганических веществ |
|
|
|
Резервное время |
|
1. Решение задач |
|
|
|
|
|
|
||||
- Описание учебно-методического и материально-технического обеспечения образовательной деятельности
Химические реактивы и материалы.
Обращение со многими веществами требует строгого соблюдения правил техники безопасности, особенно при выполнении опытов самими учащимися. Все необходимые меры предосторожности указаны в соответствующих документах и инструкциях, а также в пособиях для учителей химии.
Наиболее часто используемые реактивы и материалы: простые вещества - цинк;
кислоты - соляная, серная, азотная;
основания - гидроксид натрия, гидроксид кальция, гидроксид калия, гидроксид бария, 25%-ный водный раствор аммиака;
соли - хлорид натрия; нитраты калия, натрия, серебра, алюминия, кальция, меди, аммония; сульфаты меди(II), железа(II), алюминия, аммония, калия, магния, никеля, кобольта; гидросульфат натрия; сульфид натрия; сульфит натрия; карбонаты аммония, калия, натрия, меди; гидрокарбоны калия и натрия;
органические соединения - крахмал, глицирин, уксусная кислота Химическая лабораторная посуда, аппараты и приборы.
Химическая посуда подразделяется на две группы: для выполнения опытов учащимися и демонстрационных опытов.
Приборы, аппараты и установки, используемые на уроках химии, подразделяют на основе протекающих в них физических и химических процессов с участием веществ, находящихся в разных агрегатных состояниях:
- приборы для работы с газами - получение, собирание;
- аппараты и приборы для опытов с жидкими и твердыми веществами - фильтрование, кристаллизация; проведение реакций между твердым веществом и жидкостью, жидкостью и жидкостью, твердыми веществами.
Вспомогательную роль играют измерительные и нагревательные приборы, различные приспособления для выполнения опытов. Модели.
Наборы моделей атомов для составления шаростержневых моделей молекул при изучении органической химии. Учебные пособия на печатной основе.
В процессе обучения химии используются следующие таблицы постоянного экспонирования: «Периодическая система химических элементов Д. И. Менделеева», «Таблица растворимости кислот, оснований и солей», «Электрохимический ряд напряжений металлов».
Для организации самостоятельной работы обучающихся на уроках используют разнообразные дидактические материалы: тетради на печатной основе, карточки с заданиями разной степени трудности для изучения нового материала, самопроверки и контроля знаний учащихся.
Экранно-звуковые средства обучения.
Список сайтов по химии для учащихся и учителя
|
№ |
Название сайта или статьи |
Содержание |
Адрес (Url) |
|
1 |
Химия и жизнь: научно-популярный журнал |
Электронная версия научно-популярного журнала. Архив содержаний номеров. Доступ к полной версии журнала через регистрацию. Оформление подписки |
|
|
2 |
Alhimik |
Полезные советы, эффектные опыты, химические новости, виртуальный репетитор, консультации, казусы и Т.Д. |
|
|
3 |
C-BOOKS |
Литература по химии |
|
|
4 |
Азбука веб-поиска для химиков |
Методика поиска информации по химии. Обзор бесплатных патентных баз данных. Ежемесячные аннотации новых химических научных ресурсов |
http://www.chemistry. bsu.by/abc/ |
|
5 |
Механизмы органических реакций |
Основные типы механизмов химических реакций |
http://www.tl.ru /~gimnl3/docs/ ximia/him2.htm http://www.tl.ru |
|
6 |
Опорные конспекты по химии |
Поурочные конспекты для школьников 8— 11-х классов |
http://khimia.ri 1 .ru/ |
|
7 |
Опыты по неорганической химии |
Описания реакций, фотографии, справочная информация |
http://shnic.narod.ru/ |
|
8 |
Периодическая система химических элементов |
История открытия элементов и происхождение их названий, описание физических и химических свойств |
http://www.jergym.hiedu. cz/~canovm/vyhledav/variarity/ rusko2.html |
|
9 |
Расчетные задачи по химии |
Сборник расчетных задач по неоргани-ческой и органической химии для работы на школьном спецкурсе. Список литер-ры |
http://lyceuml.ssu.runnet. ru/~vdovina/sod.html |
|
10 |
Химия для всех |
Электронный справочник за полный курс химии |
http://www.informika.ru/text/ database/chemy/START.html |
|
11 |
Школьная химия — справочник |
Справочник и учебник по химии. Главная особенность — химкалькулятор, который упрощает решение задач по химии |
http ://www. schoolchemistry.by. ru |
|
12 |
Электронная библиотека по химии |
Книги и аналитические обзоры. Учебники. Журналы. Учебные базы данных. Нобелевские премии по химии |
http ://www. chemnet.ru/rus/ elbibch.html |
|
13 |
Общая и неорганическая химия: часть 1 |
Материалы по общей химии для учащихся химико-биологических классов: основные понятия химии, строение атома, химическая связь |
http://lib.morg.chem.msu.ru/ tutorials/korenev/1 .doc |
|
14 |
Общая и неорганическая химия: часть 2 |
Материалы по неорганической химии для учащихся специализированных химико-биологических классов: основные классы неорганических соединений, их свойства и |
http://lib.inorg.chem.msu.ru/ tutorials/korene v/2 .doc |
|
|
|
способы получения |
|
|
15 |
Экспериментальный учебник по химии для 8— 9-х классов |
Учебное пособие по общей химии, отличающееся научной строгостью изложения и системой определений |
http://www.chem.msu.su/rus/ school/zhukovl/welcome.html |
|
16 |
Программное Обеспечение по химии |
Аннотированные ссылки на существующие программные ресурсы по химии |
http://chemicsoft.chat.ru/ |
|
17 |
Электронная библиотека по химии |
Сборник российских научных и образовательных публикации по химии. Справочная информация и базы данных по химии. Материалы для школьников. Электронные учебники. Задания вступительных экзаменов по химии в МГУ. Задачи химических олимпиад. Мультимедиа-публикации |
http://www.chem.msu.su/rus/ elibrary |
|
18 |
Репетитор по химии |
Интерактивный курс подготовки к централизованному тестированию и ЕГЭ по химии. Для зарегистрированных пользователей: тесты, теоретический разбор решений. В свободном доступе: пробные тесты, литература, некоторые химические программы. Методические рекомендации для подготовки к ЦТ и ЕГЭ по химии |
http://chemistry.nm.ru/ |
|
19 |
Российская дистанционная олимпиада школьников по химии |
Дистанционные олимпиады по химии |
http://www.muctr.edu.ru/ olimpiada/ |
|
20 |
Химическая страничка |
Материалы олимпиад по химии. Описание опытов. Свойства элементов. Химические свойства минералов. Словарь химических терминов |
http://www-windows- 125 1 .edu. yar.ru/russian/cources/chem/ |